
اکسیژن گازی بیرنگ، بیبو و بسیار واکنشپذیر است که بهصورت مولکول دو اتمی O₂ حدود ۲۱٪ هوای تنفسی ما را تشکیل میدهد. از نظر علمی، اکسیژن یک عنصر شیمیایی با نماد O و عدد اتمی ۸ در گروه ۱۶ جدول تناوبی است که با بیشتر عناصر ترکیب شده و اکسیدها و پراکسیدهای مختلف میسازد. این گاز در طبیعت عمدتاً طی فرایند فتوسنتز توسط گیاهان و جلبکها تولید میشود و مهمترین نقش آن در بدن انسان، ورود به ریهها، اتصال به هموگلوبین خون و شرکت در تنفس سلولی برای تولید انرژی است. اکسیژن علاوه بر امکاندادن به تنفس و حیات، در احتراق، فولادسازی، شیشهسازی، تصفیه آب و فاضلاب، پزشکی (اکسیژندرمانی) و به شکل اکسیژن مایع در صنایع بزرگ و هوافضا کاربرد گسترده دارد؛ به همین دلیل اغلب از آن با عنوان «گاز زندگی» یاد میشود.
.jpg)
| مشخصه | مقدار | توضیح / واحد |
|---|---|---|
| نماد شیمیایی | O₂ | مولکول دو اتمی اکسیژن |
| عدد جرمی | 15.9994 g/mol | جرم اتمی متوسط اکسیژن |
| عدد اتمی | 8 | تعداد پروتون در هسته اتم اکسیژن |
| چگالی گاز (۰°C و ۱ atm) | 1.4290 g/L | چگالی گاز اکسیژن در شرایط استاندارد |
| چگالی مایع در نقطه جوش | 1.141 g/cm³ | چگالی اکسیژن مایع در دمای جوش |
| نقطه ذوب | -218.79 °C (-361.82 °F) | تبدیل فاز جامد به مایع |
| نقطه جوش | -182.95 °C (-297.31 °F) | تبدیل فاز مایع به گاز در فشار اتمسفری |
| گرمای همجوشی | 0.444 kJ/mol | انرژی لازم برای ذوب هر مول اکسیژن جامد |
| گرمای تبخیر | 6.82 kJ/mol | انرژی لازم برای تبخیر هر مول اکسیژن مایع |
| نقطه بحرانی | 5.043 MPa ، 154.59 K | فشار و دمای بحرانی اکسیژن |
| ظرفیت گرمایی مولی | 29.378 J/(mol·K) | در حالت گاز، در شرایط استاندارد |
| عددهای اکسایش متداول | -2، -1، 0، +1، +2 | بسته به نوع ترکیب و محیط واکنش |
سایر ویژگیهای مهم گاز اکسیژن:
گاز اکسیژن یکی از پرکاربردترین گازهای صنعتی و پزشکی است که بسته به نوع مصرف، سطح خلوص و روش نگهداری، در شکلهای مختلفی تولید و عرضه میشود. شناخت انواع گاز اکسیژن بر اساس کاربرد، نقش مهمی در انتخاب درست و استفاده ایمن از آن دارد. مهمترین انواع اکسیژن شامل اکسیژن پزشکی، اکسیژن صنعتی و اکسیژن مایع است.
اکسیژن پزشکی نوعی از گاز اکسیژن با خلوص بالا است که بهطور ویژه برای مصارف درمانی و تنفسی تولید میشود. این نوع اکسیژن در بیمارستانها، مراکز درمانی، آمبولانسها و تجهیزات کمکتنفسی کاربرد دارد.
در تولید گاز اکسیژن پزشکی، استانداردهای دقیق کنترل کیفیت رعایت میشود تا اکسیژن کاملاً ایمن و عاری از آلودگی برای استفاده انسانی باشد.
اکسیژن صنعتی یکی از پرمصرفترین انواع گاز اکسیژن در بخش صنعت به شمار میرود. این نوع اکسیژن در جوشکاری، برش فلزات، صنایع فولاد، پتروشیمی و پالایشگاهها استفاده میشود.
اگرچه خلوص اکسیژن صنعتی برای فرآیندهای صنعتی مناسب است، اما به دلیل تفاوت در استانداردها، برای مصرف پزشکی و تنفسی قابل استفاده نیست.
اکسیژن مایع حالتی از گاز اکسیژن است که در دمای بسیار پایین به شکل مایع ذخیره میشود. این روش نگهداری امکان ذخیره حجم بالایی از اکسیژن را در فضای کمتر فراهم میکند.
اکسیژن مایع بیشتر در بیمارستانهای بزرگ، صنایع سنگین و مراکز با مصرف بالای اکسیژن کاربرد دارد و پیش از مصرف، به حالت گاز تبدیل میشود.

تاریخچه گاز اکسیژن به قرن هجدهم میلادی برمی گردد که شیمیدانها هنوز نمیدانستند «هوا» از چه چیزی تشکیل شده است. نظریهای به نام «فلوژیستون» وجود داشت که میگفت مواد هنگام سوختن، جوهری به نام فلوژیستون را از دست میدهند. آزمایشهای مختلف روی فلزات و مواد سوختنی نشان میداد جرم آنها بعد از سوختن تغییر میکند، اما توضیح دقیقی برای آن وجود نداشت.
در دههی ۱۷۷۰، جوزف پریستلی و کارل شیله بهطور مستقل گازی را جدا کردند که شعله را شدیدتر میسوزاند و تنفس را راحتتر میکند، اما هنوز نقش واقعی آن را درک نکرده بودند. آنتوان لاووازیه، شیمیدان فرانسوی، با تحلیل دقیق این آزمایشها نشان داد که این گاز یک عنصر مستقل است، نظریهی فلوژیستون را رد کرد و مفهوم اکسید شدن را پایه گذاشت. از آن زمان، اکسیژن به عنوان یکی از مهمترین عناصر در شیمی مدرن شناخته شد.
| سال تقریبی | دانشمند / گروه | کشور | دستاورد مرتبط با اکسیژن |
|---|---|---|---|
| اواسط قرن ۱۸ | شیمیدانان مختلف | اروپا | آزمایشهای اولیه روی سوختن و تغییر جرم مواد، طرح نظریه فلوژیستون |
| ۱۷۷۱–۱۷۷۴ | کارل ویلهلم شیله | سوئد | تولید گاز حاوی اکسیژن از تجزیه ترکیبات مختلف، بدون نامگذاری نهایی |
| ۱۷۷۴ | جوزف پریستلی | انگلیس | تولید گاز اکسیژن از تجزیه اکسید جیوه و مشاهده تشدید شعله و تنفس |
| اواخر دهه ۱۷۷۰ | آنتوان لاووازیه | فرانسه | شناخت اکسیژن بهعنوان عنصر مستقل، رد نظریه فلوژیستون و معرفی مفهوم اکسید شدن |
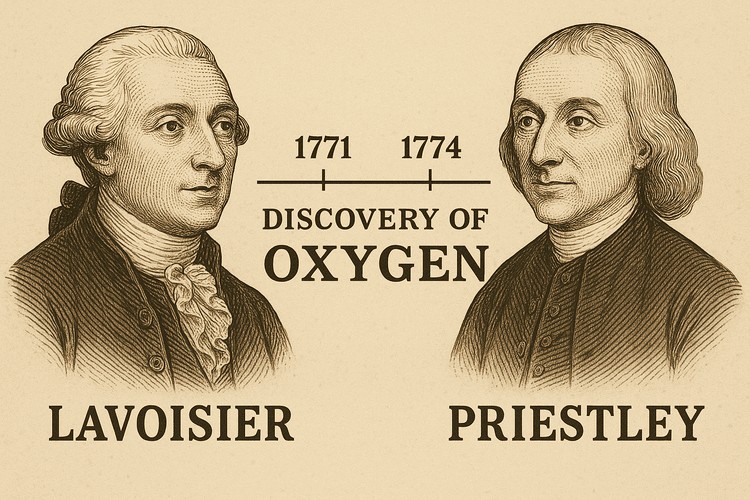
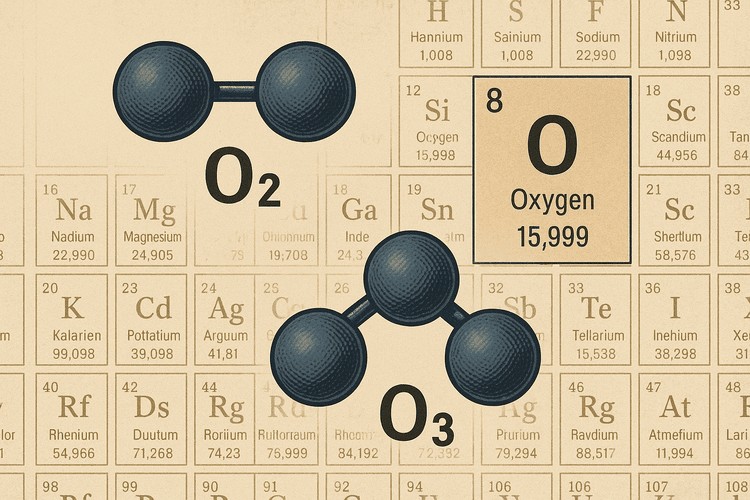
اکسیژن بهصورت مولکول دو اتمی یعنی O₂ در جو و در سیستم تنفسی ما حضور دارد. هر مولکول O₂ از دو اتم اکسیژن تشکیل شده که با پیوند دوگانه به هم متصلاند. این تفاوت مهمی با نماد O دارد که به یک اتم اکسیژن اشاره میکند و در شرایط عادی به صورت جداگانه پایدار نیست.
جرم اتمی اکسیژن طبیعی حدود ۱۶ واحد جرم اتمی است. از آنجا که مولکول اکسیژن O₂ از دو اتم تشکیل شده، جرم مولکولی آن حدود ۳۲ واحد جرم اتمی است. این عدد برای محاسبات شیمی، استوکیومتری و تعیین مقدار گاز مورد نیاز در واکنشها و فرآیندهای صنعتی استفاده میشود.
اکسیژن سه ایزوتوپ پایدار اصلی دارد: اکسیژن-۱۶، اکسیژن-۱۷ و اکسیژن-۱۸. اکسیژن-۱۶ فراوانترین ایزوتوپ است و بیشترین سهم را در ترکیب طبیعی دارد. اکسیژن-۱۸ ایزوتوپی است که بهویژه در مطالعات زمینشناسی، آبشناسی و تغییرات اقلیمی برای ردگیری منشأ و تاریخچه آبها و یخها استفاده میشود، چون نسبت O-۱۸ به O-۱۶ اطلاعات مفیدی درباره دما و شرایط محیطی گذشته میدهد.
اکسیژن علاوه بر شکل معمول دو اتمی (O₂)، بهصورت اوزون (O₃) نیز وجود دارد. اوزون آلوترپ سهاتمی اکسیژن است که در لایهی استراتوسفر، بخشی از پرتوهای فرابنفش خورشید را جذب میکند و از حیات روی زمین محافظت میکند. در نزدیکی سطح زمین، اوزون در غلظتهای بالا میتواند آلایندهی هوا و مضر برای دستگاه تنفسی باشد.
وقتی میگوییم «عنصر اکسیژن» منظورمان مادهای است که از اتمهای اکسیژن تشکیل شده (مثلاً O₂ خالص). اما هوایی که تنفس میکنیم مخلوطی از گازهاست: نیتروژن، اکسیژن، آرگون، دیاکسید کربن و… بنابراین هوای معمولی یک مخلوط است، اما گاز اکسیژن فشرده در کپسولها میتواند تا حدود ۹۹ درصد خلوص داشته باشد و در این حالت، آن را بهعنوان گاز اکسیژن خالص در نظر میگیرند.
اکسیژن در گروه ۱۶ (گروه کالکوژنها) و دورهی دوم جدول تناوبی قرار دارد. در دمای اتاق بهصورت گاز، بیرنگ و بیبو است، اما در حالت مایع رنگ آبی کمرنگی دارد. کمی سنگینتر از هوای خشک است و نقطهی جوش آن حدود منفی ۱۸۳ درجه سلسیوس است.
| نوع | فرمول شیمیایی | حالت در دمای اتاق | رنگ | دمای جوش تقریبی (°C) | کاربرد اصلی | نکته ایمنی مهم |
|---|---|---|---|---|---|---|
| گاز اکسیژن معمولی | O₂ | گاز | بیرنگ | -۱۸۳ | تنفس، احتراق، فرآیندهای صنعتی و پزشکی | افزایش شدید خطر آتشسوزی در حضور مواد سوختنی |
| اوزون | O₃ | گاز | آبی کمرنگ (در غلظت بالا) | -۱۱۲ | جذب پرتو فرابنفش در لایه ازن، کاربردهای محدود ضدعفونی | در غلظت بالا برای دستگاه تنفسی سمی و تحریککننده است |
| اکسیژن مایع | O₂ (حالت مایع) | مایع بسیار سرد | آبی کمرنگ | -۱۸۳ | سوخت موشک، ذخیرهسازی حجیم اکسیژن، صنایع و پزشکی | تماس مستقیم باعث سوختگی سرمایی؛ نیازمند مخازن عایق و تهویه مناسب |
در طبیعت، اکسیژن به شکلهای مختلفی حضور دارد:
گیاهان، جلبکها و فیتوپلانکتونهای موجود در دریا با فرآیند فتوسنتز، دیاکسید کربن و آب را با استفاده از انرژی نور خورشید به قند و اکسیژن تبدیل میکنند. این فرآیند بزرگترین منبع تولید اکسیژن آزاد در جو است و بدون آن، اکسیژن تنفسی بهسرعت مصرف و جو خفه میشد.
حیوانات و انسانها اکسیژن را مصرف و دیاکسید کربن تولید میکنند. همینطور بسیاری از میکروارگانیسمها نیز در تجزیه مواد آلی و تنفس، از اکسیژن استفاده میکنند. به این ترتیب، چرخهای بین فتوسنتز و تنفس شکل میگیرد که سطح اکسیژن و دیاکسید کربن را در جو تا حدی متعادل نگه میدارد.
ترکیب مناسب اکسیژن در جو برای حیات ضروری است؛ اگر درصد اکسیژن خیلی کم شود، تنفس دشوار میشود و اگر خیلی زیاد شود، خطر آتشسوزی و واکنشهای ناخواسته شدیداً بالا میرود. بنابراین وجود اکسیژن هم نعمت است و هم نیازمند تعادل و مراقبت محیطزیستی.
| نقش در چرخه | نمونه / مثال | شرح عملکرد | تأثیر بر سطح اکسیژن جو |
|---|---|---|---|
| منبع تولید اکسیژن | گیاهان خشکی | فتوسنتز، تبدیل CO₂ و آب به قند و اکسیژن با استفاده از نور خورشید | افزایش اکسیژن آزاد در جو |
| منبع تولید اکسیژن | جلبکها و فیتوپلانکتونهای دریایی | فتوسنتز در اقیانوسها؛ سهم بسیار زیاد در تولید اکسیژن جهانی | افزایش اکسیژن و تنظیم تعادل گازها در جو |
| مصرفکننده اکسیژن | حیوانات و انسان | تنفس سلولی، مصرف اکسیژن برای تولید انرژی و آزاد کردن CO₂ | کاهش موضعی اکسیژن و افزایش CO₂ |
| مصرفکننده اکسیژن | میکروارگانیسمهای تجزیهکننده | تجزیه مواد آلی در خاک و آب با استفاده از اکسیژن | مصرف اکسیژن بهویژه در آبها و رسوبات غنی از مواد آلی |
| مصرفکننده اکسیژن | سوختن سوختهای فسیلی | احتراق نفت، گاز و زغالسنگ در نیروگاهها و خودروها | مصرف اکسیژن و افزایش CO₂ و آلایندهها |
%20(1).jpg)
اکسیژن بهطور طبیعی تمایل دارد با بسیاری از عناصر دیگر واکنش دهد و اکسید تشکیل دهد. این خاصیت، آن را به یک عامل اکسیدکننده قوی تبدیل میکند. زنگ زدن آهن، سوختن چوب، تیره شدن سطح سیب برشخورده در هوا، همگی نمونههایی از واکنشهای اکسیداسیون هستند.
وقتی اکسیژن با فلزات واکنش میدهد، معمولاً اکسید فلزی تولید میشود؛ مانند اکسید آهن (زنگ آهن) یا اکسید آلومینیوم که لایهای محافظ روی سطح آلومینیوم میسازد. واکنش با نافلزات نیز میتواند اکسیدهای اسیدی مانند دیاکسید کربن (CO₂) یا دیاکسید گوگرد (SO₂) ایجاد کند.
علاوه بر اکسیدها، ترکیباتی مانند پراکسیدها و سوپراکسیدها نیز وجود دارند که در آنها اکسیژن با نسبتهای خاصی شرکت میکند، مثلاً پراکسید هیدروژن (H₂O₂) که بهعنوان ضدعفونیکننده و سفیدکننده استفاده میشود. این ترکیبات معمولاً واکنشپذیرتر و ناپایدارترند و در صنعت و پزشکی کاربردهای خاص دارند.
بهطور کلی، فلزات فعال مانند فلزات قلیایی با سرعت و شدت بیشتری با اکسیژن واکنش میدهند و اکسیدهای یونی میسازند، در حالی که نافلزات ممکن است اکسیدهایی با ویژگیهای اسیدی یا خنثی ایجاد کنند. هرچه تمایل یک عنصر به از دست دادن یا گرفتن الکترونها بیشتر باشد، نوع و شدت واکنشش با اکسیژن نیز متفاوت است.
| نام ترکیب | فرمول شیمیایی | نوع (فلزی / غیرفلزی) | رفتار اسیدی / بازی | نمونه کاربرد یا اهمیت |
|---|---|---|---|---|
| اکسید آهن (زنگ آهن) | Fe₂O₃ | فلزی | معمولاً بازی یا آمفوتر ضعیف | تشکیل زنگ آهن، اهمیت در خوردگی و حفاظت فلزات |
| اکسید آلومینیوم | Al₂O₃ | فلزی | آمفوتر | لایه محافظ روی آلومینیوم، کاربرد در سرامیک و سایندهها |
| دیاکسید کربن | CO₂ | غیرفلزی | تشکیل اسید کربنیک در آب (رفتار اسیدی) | نقش در تنفس، فتوسنتز، تغییرات اقلیمی و نوشابههای گازدار |
| دیاکسید گوگرد | SO₂ | غیرفلزی | اسیدی | آلاینده هوا، پیشماده باران اسیدی |
| اکسید کلسیم (آهک زنده) | CaO | فلزی | بازی | مصالح ساختمانی، تولید سیمان، خنثیسازی محیطهای اسیدی |
واکنش هیدروژن و اکسیژن منجر به تشکیل آب (H₂O) میشود. این واکنش بسیار گرمازا است و در موتورهای موشکی و برخی سوختهای خاص از آن استفاده میشود.
واکنش اکسیژن با عناصر گروه ۱ (فلزات قلیایی)
فلزات قلیایی مانند لیتیوم، سدیم و پتاسیم بهشدت با اکسیژن واکنش میدهند و اکسید، پراکسید یا سوپراکسید تشکیل میدهند.
%20(1)%20(1).jpg)
| گروه جدول تناوبی | نمونه عناصر | نوع ترکیب اصلی | ویژگی کلی | مثال |
|---|---|---|---|---|
| گروه ۱ (فلزات قلیایی) | لیتیوم، سدیم، پتاسیم | اکسید، پراکسید، سوپراکسید | واکنش بسیار شدید، تشکیل ترکیبات یونی | Na₂O، Na₂O₂، KO₂ |
| گروه ۲ (فلزات قلیایی خاکی) | منیزیم، کلسیم | اکسید فلزی | تشکیل اکسیدهای پایدار، اغلب با نقطه ذوب بالا | MgO، CaO |
| گروه ۱۳ | بور، آلومینیوم | اکسیدهای شبکهای | لایه محافظ روی فلزات، سخت و مقاوم | B₂O₃، Al₂O₃ |
| گروه ۱۴ | کربن، سیلیسیم | اکسیدهای مولکولی و شبکهای | ترکیبات مهم زیستی و صنعتی | CO₂، SiO₂ |
| گروه ۱۵ | نیتروژن، فسفر | اکسیدهای مختلف با حالتهای اکسایش متفاوت | نقش در کودها، آلودگی هوا، فرآیندهای زیستی | NO، NO₂، P₂O₅ |
| گروه ۱۶ | گوگرد، سلنیوم | اکسیدهای اسیدی | برخی از آنها در تشکیل باران اسیدی مؤثرند | SO₂، SO₃ |
| گروه ۱۷ | فلوئور | اکسیفلوئوریدها | ترکیبات بسیار واکنشپذیر و ناپایدار | O₂F₂ |
| گروه ۱۸ | گازهای نجیب | ترکیبات کمتعداد و پرشرط | عموماً بیواکنش؛ ترکیب فقط در شرایط خاص | نمونهها نادر و آزمایشگاهی |
در صنعت، اکسیژن عمدتاً از هوا بهدست میآید، چون هوای محیط منبعی ارزان و فراوان است. یکی از روشهای متداول، تقطیر جزءبهجز هوای مایع است: هوا را فشرده و سرد میکنند تا مایع شود، سپس با گرم کردن تدریجی، اجزا بر اساس نقطه جوشهای مختلف از هم جدا میشوند و اکسیژن تقریبا خالص بهدست میآید.
روش دیگر، فناوری PSA (Pressure Swing Adsorption) است که در آن هوا از بسترهای جذبی عبور میکند و نیتروژن بیشتر جذب میشود، در حالی که اکسیژن غنیشده از سیستم خارج میشود. این روش بهویژه در تولید اکسیژن پزشکی و واحدهای کوچکتر کاربرد دارد.
| روش | اصل کار | خلوص معمول اکسیژن | مقیاس مناسب | مزیت اصلی | محدودیت / عیب |
|---|---|---|---|---|---|
| تقطیر جزءبهجز هوای مایع | مایع کردن هوا و جداسازی اجزا بر اساس نقطه جوش | خیلی بالا (تا حدود ۹۹٪ و بالاتر) | واحدهای بزرگ صنعتی | حجم تولید زیاد، مناسب برای صنایع سنگین و بیمارستانهای بزرگ | سرمایهگذاری و مصرف انرژی بالا، تجهیزات پیچیده |
| PSA (جذب نوسانی فشار) | جذب انتخابی نیتروژن روی بستر و عبور اکسیژن | حدود ۹۰–۹۶٪ | واحدهای کوچک تا متوسط، سیستمهای پزشکی | راهاندازی سریعتر، امکان تولید در محل مصرف | خلوص پایینتر نسبت به تقطیر، نیاز به نگهداری بسترهای جذبی |
.jpg)
| روش | واکنش / فرآیند اصلی | مواد اولیه | شرایط لازم | حجم تولید تقریبی | سطح خطر |
|---|---|---|---|---|---|
| تجزیه حرارتی نمکهای خاص | تجزیه کلرات یا نیترات با آزاد شدن O₂ | کلرات پتاسیم، نیتراتها | گرم کردن کنترلشده با شعله یا کوره | کم تا متوسط (آزمایشگاهی) | متوسط؛ خطر دما و احتمال انفجار در صورت مصرف نادرست |
| تجزیه حرارتی اکسیدهای فلزات سنگین | تجزیه اکسید با تشکیل فلز و O₂ | برخی اکسیدهای فلزی (مثل اکسید جیوه) | دمای بالا، وسایل ایمن | کم | متوسط تا بالا؛ بسته به نوع فلز و بخارات سمی |
| تجزیه پراکسیدها | تجزیه H₂O₂ یا پراکسیدهای فلزی به آب و O₂ | پراکسید هیدروژن، پراکسیدهای فلزی | گرما و/یا کاتالیزور | کم تا متوسط | متوسط؛ خورندگی، خطر سوختگی شیمیایی |
| الکترولیز آب | تجزیه H₂O به H₂ و O₂ با جریان برق | آب و مقدار کمی نمک یا اسید بهعنوان الکترولیت | منبع برق، الکترود مناسب | کم | نسبتاً کم؛ با رعایت ایمنی برق و هیدروژن |
| نوع | حالت فیزیکی | شرایط نگهداری | چگالی / حجم ذخیرهسازی | کاربردهای رایج | نکات ایمنی مهم |
|---|---|---|---|---|---|
| گاز اکسیژن فشرده | گاز تحت فشار در سیلندر | دمای محیط، فشار بالا | حجم ذخیره متوسط (کمتر از LOX در همان فضا) | پزشکی، آزمایشگاه، جوشکاری، مصارف عمومی صنعتی | خطر ترکیدن سیلندر، افزایش ریسک آتشسوزی، نیاز به مهار و حملونقل ایمن |
| اکسیژن مایع (LOX) | مایع بسیار سرد | دمای بسیار پایین، مخازن عایقدار | چگالی بالا، امکان ذخیره حجم زیاد در فضای محدود | صنایع بزرگ، هوافضا، بیمارستانها و کارخانههای فولاد | خطر سوختگی سرمایی، انفجار در صورت نشت و تماس با مواد سوختنی، نیاز به تهویه مناسب |
.jpg)
| حوزه | نمونه کاربرد | هدف / فایده اصلی | ریسک / نکته احتیاطی |
|---|---|---|---|
| پزشکی | اکسیژندرمانی در ICU و اتاق عمل | حفظ سطح مناسب اکسیژن خون در بیماران بدحال | نیاز به تجویز پزشک، خطر مسمومیت اکسیژن در مصرف بیرویه |
| فولادسازی و متالورژی | دمیدن اکسیژن در کوره بسمر و کورههای مدرن | افزایش دما و حذف ناخالصیها از مذاب فلز | خطر انفجار و آتشسوزی، نیاز به سیستمهای ایمنی قوی |
| صنایع پتروشیمی | اکسیداسیون کنترلشده مواد اولیه | افزایش راندمان واکنشها و تولید مواد شیمیایی مختلف | کنترل دقیق دما و غلظت اکسیژن برای جلوگیری از واکنشهای ناخواسته |
| صنعت شیشهسازی | استفاده از مشعلهای اکسیسوخت | افزایش دمای شعله و بهبود کیفیت ذوب شیشه | نیاز به عایقبندی و تهویه مناسب کوره |
| حملونقل و راهها | برش و جوشکاری فلزات در تعمیرات | امکان برش دقیق و سریع سازهها و خطوط فلزی | خطر آتشسوزی و انفجار، لزوم آموزش اپراتورها |
| تصفیه آب و فاضلاب | هوادهی و تزریق اکسیژن | بهبود کار میکروارگانیسمها در تجزیه مواد آلی | مصرف انرژی و نیاز به طراحی درست سیستم هوادهی |
| هوافضا | سوخت موشکها و سیستمهای حیاتبخش | تأمین اکسیدکننده قوی و اکسیژن تنفسی در فضا | مدیریت خطر انفجار، کنترل دقیق دما و فشار |
| کوهنوردی و ورزش | استفاده از کپسول اکسیژن در ارتفاعات | جلوگیری از هیپوکسی و کاهش علائم ارتفاعزدگی | نیاز به آموزش، خطر وابستگی یا استفاده نابجا |
| وضعیت کلی | نمونه / سناریو | علائم احتمالی | توصیه کلی |
|---|---|---|---|
| کمبود اکسیژن (هیپوکسی) | بیمار با تنگی نفس شدید | سرگیجه، سردرد، کبودی لبها، تنگی نفس | ارجاع فوری به پزشک یا اورژانس، عدم خوددرمانی با اکسیژن |
| استفاده صحیح از اکسیژن پزشکی | بیمار ریوی با تجویز پزشک | بهبود تنفس، کاهش خستگی | استفاده طبق نسخه، تنظیم دبی توسط کادر درمان |
| مصرف بیرویه اکسیژن | استفاده طولانیمدت بدون نظارت | احتمال آسیب ریه، تشنج در موارد خاص | قطع خودسرانه مصرف، مراجعه به پزشک برای تنظیم درمان |
| قرار گرفتن در هوای رقیق | کوهنوردی در ارتفاع بالا | خستگی، تنگی نفس، سردرد، تهوع | اقدامات تطابق با ارتفاع، در موارد شدید مراجعه به پزشک و استفاده کنترلشده از اکسیژن |
| نوع تجهیز | خلوص تقریبی | کاربرد اصلی | نیاز به تجویز / استاندارد پزشکی | نکته ایمنی مهم |
|---|---|---|---|---|
| کپسول اکسیژن صنعتی | متغیر، معمولاً کمتر از استاندارد پزشکی | جوشکاری، برش، فرآیندهای صنعتی | برای تنفس انسان مناسب نیست | عدم استفاده برای بیماران، خطر انفجار و آتشسوزی |
| کپسول اکسیژن پزشکی | استاندارد دارویی (مثلاً ۹۹٪) | درمان بیماران در بیمارستان و خانه | نیازمند تجویز و نظارت پزشک | تنظیم صحیح فشار، نگهداری دور از حرارت و ضربه |
| کنسانترهساز اکسیژن خانگی | حدود ۹۰–۹۶٪ | تأمین اکسیژن طولانیمدت برای بیماران مزمن | نیازمند نسخه پزشک و آموزش کاربر | تهویه مناسب محیط، مراقبت از فیلترها و برق دستگاه |
| نوع محیط | نمونه سوخت | نقش اکسیژن | روش کنترل / پیشگیری |
|---|---|---|---|
| خانه و آشپزخانه | روغن، گاز، چوب | تغذیه شعله و گسترش سریع آتش | خاموش کردن شعله با قطع گاز و بستن درب، استفاده از خاموشکننده مناسب |
| کارگاه صنعتی با سیلندر اکسیژن | فلزات، مواد قابل اشتعال اطراف | تشدید آتشسوزی در صورت نشت اکسیژن | نگهداری صحیح سیلندرها، تست نشتی، عدم نگهداری کنار مواد سوختنی |
| بیمارستان | مواد پلاستیکی، پارچه، الکل | افزایش سرعت و شدت حریق در اتاقهای اکسیژندرمانی | ممنوعیت سیگار، کنترل منابع جرقه، آموزش پرسنل |
| محیطهای بسته با اکسیژن غنیشده | هر نوع سوخت سبک | خطر شعلهور شدن ناگهانی حتی از جرقه کوچک | تهویه مناسب، پایش غلظت اکسیژن، محدود کردن منابع اشتعال |
| مورد ایمنی | شرح | مسئول / کاربر | تناوب بررسی |
|---|---|---|---|
| نگهداری سیلندر | قرار دادن سیلندر در حالت ایستاده و مهار شده، دور از حرارت و ضربه | مسئول ایمنی / صاحب سیلندر | همیشه، هنگام نصب و جابهجایی |
| جلوگیری از تماس با روغن | عدم استفاده از گریس و روغن روی شیر و اتصالات اکسیژن | تکنسین، جوشکار، کادر درمان | قبل از هر اتصال یا تعمیر |
| کنترل نشتی | بررسی نشتی با کف صابون یا تجهیزات مناسب، نه با شعله | اپراتور مسئول دستگاه | بهصورت دورهای و پس از هر تعویض اتصالات |
| آموزش کاربر | آشنایی با نحوه باز و بسته کردن شیر، تنظیم رگلاتور و استفاده از ماسک | کاربر نهایی، پرسنل درمانی | در شروع استفاده و بهروزرسانی دورهای |
| ممنوعیت آتش و سیگار | نصب علائم هشدار و جلوگیری از شعله باز در اطراف اکسیژن | همه افراد حاضر در محیط | همیشه |
| محور | نقش اکسیژن | نمونه | نکته کلیدی |
|---|---|---|---|
| حیات | تأمین اکسیژن برای تنفس سلولی | تنفس انسان و حیوانات | بدون اکسیژن، تولید انرژی در سلولها مختل میشود |
| محیطزیست | بخشی از چرخه فتوسنتز و تعادل گازهای جو | گیاهان، جنگلها، اقیانوسها | حفاظت از پوشش گیاهی یعنی حفاظت از اکسیژن آینده |
| صنعت | افزایش دما و سرعت واکنشها | فولادسازی، شیشهسازی، پتروشیمی | اکسیژن بهرهوری صنعتی را بالا میبرد اما خطر آتشسوزی را هم افزایش میدهد |
| پزشکی | کمک به درمان بیماران دچار کمبود اکسیژن | کپسول و دستگاههای اکسیژندرمانی | مصرف باید طبق تجویز پزشک و با رعایت ایمنی باشد |
| ایمنی و خطرات | تشدید آتشسوزی و امکان مسمومیت اکسیژن | نشت اکسیژن، استفاده نادرست در خانه یا صنعت | آموزش و چکلیست ایمنی برای کار با اکسیژن ضروری است |
ارسال نظر